Freesolveᵀᴹ
Indicado para lesiones de novo en las arterias coronariasa
Soporte
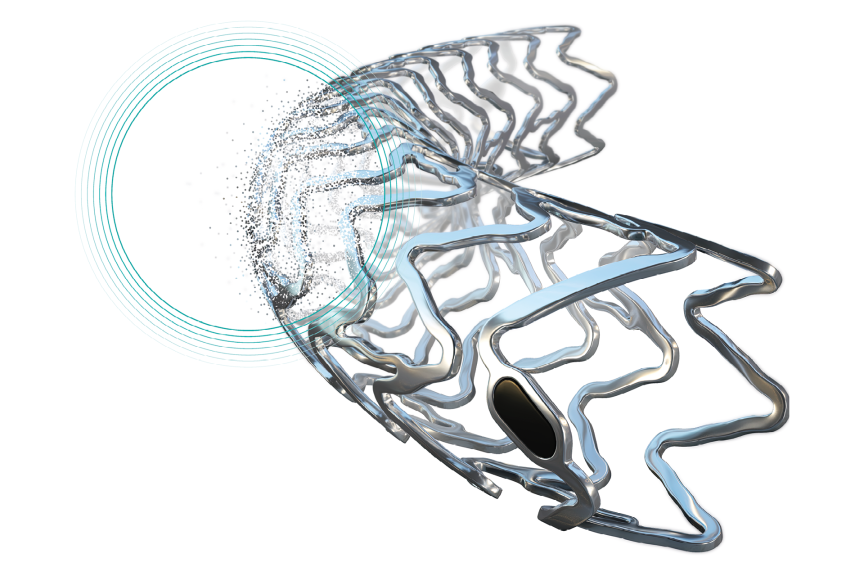
Los scaffolds coronarios reabsorbibles ensanchan las estenosis de las arterias coronarias y proporcionan un soporte temporal al vaso. De este modo, los scaffolds permiten un flujo sanguíneo sin obstrucciones en las arterias coronarias con bajas tasas de trombosis del stent (TS) y de revascularización de la lesión tratada (TLR).
Reabsorción
Al degradarse tras cumplir su función de soporte, ofrecen todas las opciones para futuras terapias.
Características principales del producto
Navega como un DES5
Óptimo soporte del vaso6,7
Reabsorción completa del magnesio a los 12 meses8
Seguridad y eficacia excelentes2,3
Proceso de reabsorción predecible y homogéneo⁶
Reabsorción uniforme entre los struts6
Forma uniforme debido a la reabsorción homogénea de los struts6
Más de 3 meses de soporte vascular6,7
>99 % de los struts no son visibles a los 12 meses8
Primer estudio en humanos (FIH, por su siglas en inglés) BIOMAG-I3
Descripción general del producto
Freesolveᵀᴹ

Nuevo concepto de marcador de tantalio para una mejor visibilidad
Struts finos
Revestimiento reabsorbible BIOlute®
Aleación de magnesio patentada BIOmag®
Datos técnicos
| Scaffold | |||||||
|---|---|---|---|---|---|---|---|
| Material del scaffold | Aleación de magnesio patentado BIOmag® | ||||||
| Grosor del strut | ø 2,5 mm: 99 μm; ø 3,0/3,5 mm: 117 μm; ø 4,0 mm: 147 μm |
||||||
| Diámetro máximo expandible | Diámetro nominal + 0,6 mm | ||||||
| Marcadores | Un marcador ovalado de tantalio en cada extremo | ||||||
| Revestimiento de fármaco | BIOlute® | (ácido poli-L-láctico, PLLA, bioabsorbible liberador de un fármaco limus) |
|||||
| Sistema de posicionamiento | |||||||
| Tipo de catéter | Intercambio rápido | ||||||
| Longitud del catéter | 140 cm | ||||||
| Catéter guía recomendado | 6 F | ||||||
| Perfil de cruce | ø 2,5 mm ≤ 1,3 mm; ø 3,0-4,0 mm ≤ 1,4 mm | ||||||
| Diámetro de la guía | 0,014” | ||||||
| Presión nominal (PN) | 10 atm | ||||||
| Presión máxima de rotura (RBP) | 16 atm | ||||||
Tamaño del vaso
| Scaffold ø (mm) (DS) |
Recomendado ø (mm) (DVR) |
|---|---|
| 2,50 | 2,50 - 2,70 |
| 3,00 | 2,70 - 3,20 |
| 3,50 | 3,20 - 3,70 |
| 4,00 | 3,70 - 4,20 |
Tabla de distensibilidad
| Diámetro del balón (mm) | ||||
|---|---|---|---|---|
| ø 2,50 | Ø 3,00 | Ø 3,50 | ||
| Presión nominal (PN) |
atm** ø (mm) |
10 2,52 |
10 3,04 |
10 3,54 |
| Presión máxima de rotura (RBP) |
atm** ø (mm) |
16 2,72 |
16 3,29 |
16 3,79 |
| *1 atm = 1.013 bar | ||||
Información de pedido
| ø del scaffold (mm) |
Longitud del scaffold (mm) |
||||
|---|---|---|---|---|---|
| 13 | 18 | 22 | 26 | 30 | |
| 2,50 | 443103 | 443104 | 443105 | - | - |
| 3,00 | 443108 | 443109 | 443110 | 482156 | 443111 |
| 3,50 | 443113 | 443114 | 443115 | 482157 | 443116 |
| 4,00 | 443118 | 443119 | 443120 | 482158 | 443121 |
Descargas y enlaces relacionados
Descargas
Enlaces relacionados
Media
Entrevistas KOL
¿En qué podemos ayudarle?
Referencias
El fallo de la lesión tratada (TLF, por sus siglas en inglés) es un compuesto de infarto de miocardio del vaso tratado (TV-MI, por sus siglas en inglés), revascularización de la lesión tratada guiada clínicamente (CD-TLR, por sus siglas en inglés) y muerte cardiaca. *Reabsorbido en un 99,3 % a los 12 meses (los marcadores no son reabsorbibles), basado en datos clínicos; **basado en datos comparativos de QCA; a.) Indicaciones según el manual técnico; b.) Caso de BIOMAG-I en proyección cinemática normal, cortesía del Prof. Michael Haude, Rheinland Klinikum Neuss GmbH, Lukaskrankenhaus, Neuss, Alemania; c.) DES Xience Sierra (Abbott); d.) Análisis angiográficos y OCT derivados de dos casos de BIOMAG-I diferentes, cortesía del Prof. Michael Haude, Rheinland Klinikum Neuss GmbH, Lukaskrankenhaus, Neuss, Alemania; e.) Se respetó el protocolo 4P.
1. Datos de la prueba de laboratorio IIB, datos registrados de BIOTRONIK; 2. Haude M. et al., the Lancet eClinicalMedicine 2023;59: 101940; 3. Haude, M et al. EuroIntervention 2023;19:1-1 publicado online, mayo 2023; 4. Seguchi M et al. Análisis OCT a los 12 meses, presentado en ESC 2023; 5. Datos en archivo de BIOTRONIK, datos de la prueba de laboratorio IIB: Freesolve en comparación con BIOTRONIK Orsiro Mission y Abbott Xience Sierra; 6. Basado en datos preclínicos, Seguchi, M et al. EuroIntervention 2023;18-publicación online previa a la versión impresa, enero 2023; 7. Datos en archivo de BIOTRONIK, en comparación con el dispositivo predecesor; 8. Basado en el análisis de OCT intravascular del estudio BIOMAG-I presentado por el Dr. M. Seguchi en el congreso ESC 2023; 9. Datos registrados de BIOTRONIK; 10. Byrne, RA. et al., Eur Heart J 2015;36:2608-2620; 11. Haude M., et al. Sustained safety and performance of the second-generation drug-eluting absorbable metal scaffold in patients with de novo coronary lesions: 12-month clinical results and angiographic findings of the BIOSOLVE-II first-in-man trial. Eur Heart J. 2016;37:2701-9; 12. «BIOMAG-I: Two-year clinical outcomes of the resorbable magnesium Scaffold-DREAMS 3G», póster electrónico moderado presentado por el profesor Haude en EuroPCR 2024.
BIOSOLVE-II y BIOMAG-1 según el análisis de estimación del fracaso de Kaplan-Meier.
BIOlute, BIOmag, BIOMAG, BIOSOLVE, Orsiro, Orsiro Mission, Magmaris y Freesolve son marcas o marcas registradas del grupo de empresas BIOTRONIK. El resto de marcas comerciales son propiedad de sus respectivos propietarios.