Magmaris®
Magmaris to pierwsze na rynku sprawdzone klinicznie bioresorbowalne rusztowanie magnezowe1-4. Wyrób ten jest obecnie przeznaczony do leczenia zmian de novo przy średnicy referencyjnej naczynia i długości zmiany ściśle odpowiadającym dostępnym rozmiarom wyrobu Magmarisᵃ⁵.
Najważniejsze cechy produktu
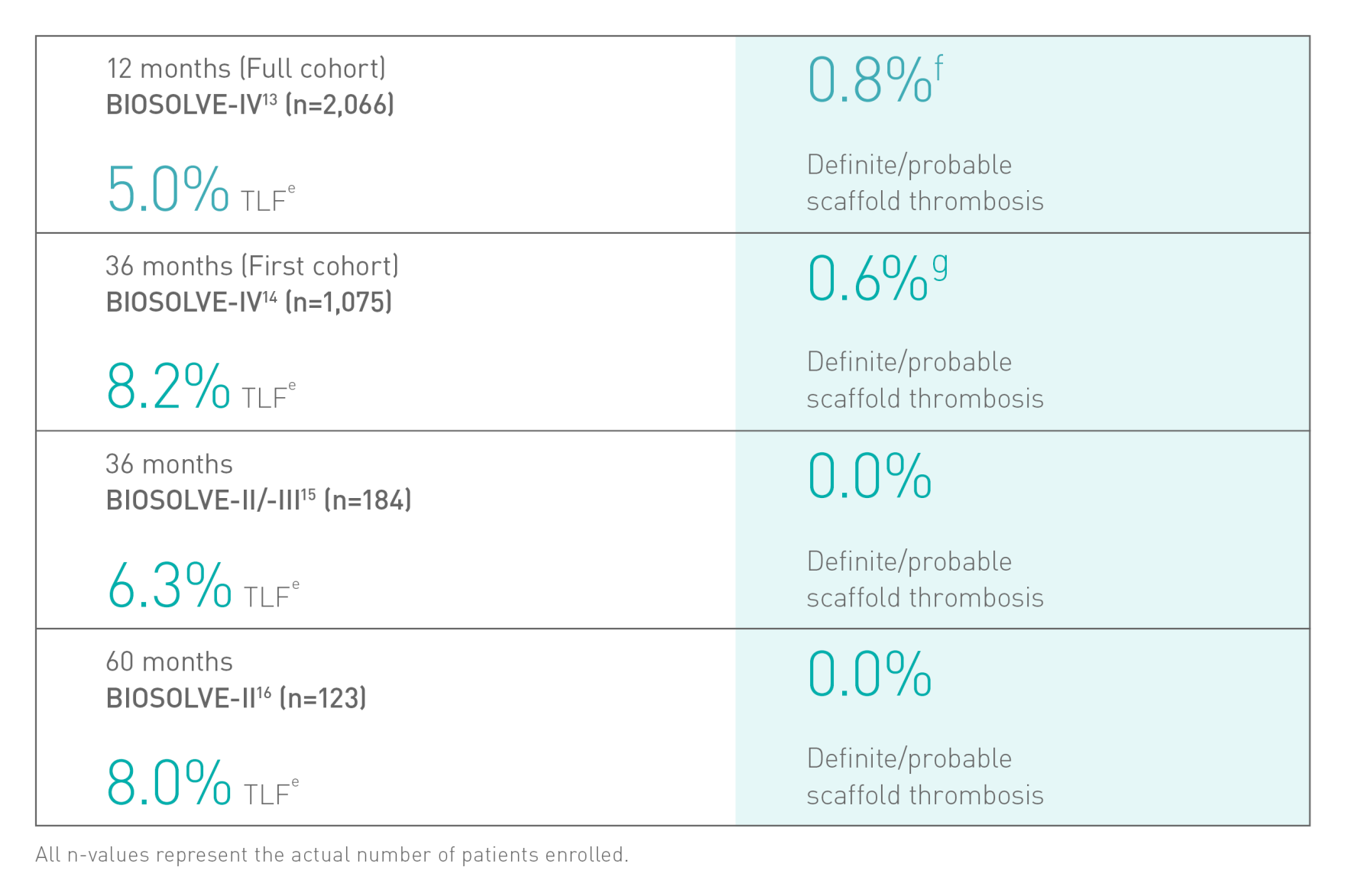
Bezpieczeństwo i skuteczność potwierdzone klinicznieb6-8
Pewność dzięki dowodom
Krótki czas wchłaniania magnezu
~95% magnezu ulega wchłonięciu w ciągu 12 miesięcy9
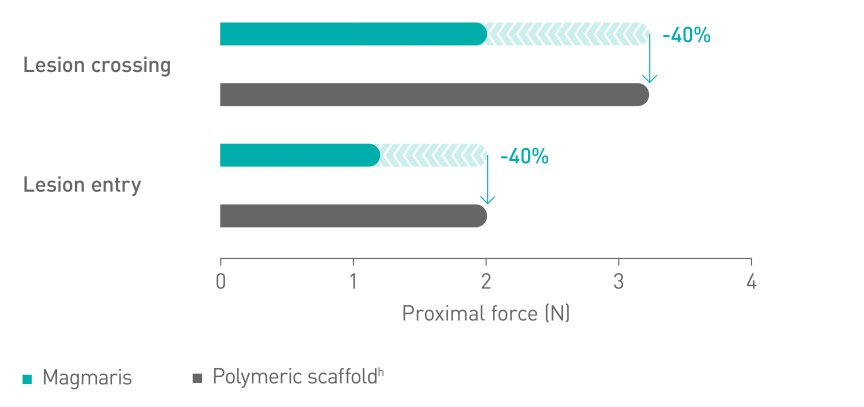
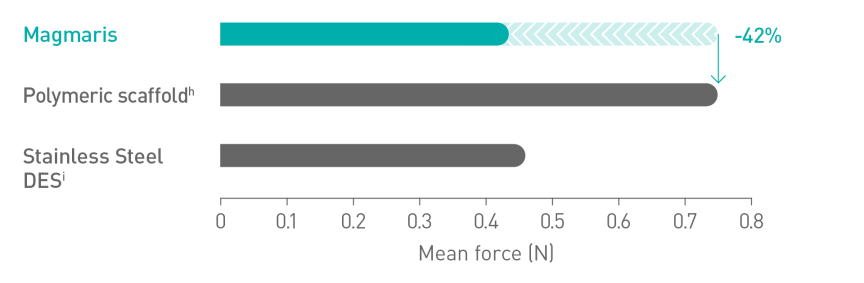
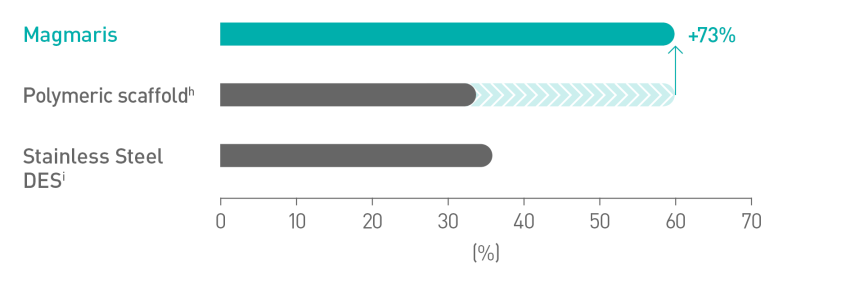
Skuteczniejsze wprowadzaniec10
Gładsza powierzchnia rusztowania dzięki zawartości magnezu11
Ogólne informacje o produkcie
Magmaris

Podwójne znaczniki RTG
Magnezowy szkielet
Powłoka BIOlute®
Dane techniczne
| Rusztowanie | |
|---|---|
| Materiał rusztowania | Opatentowany stop magnezu |
| Markery | Dwa markery z tantalu na obu końcach |
| Aktywna powłoka | BIOlute® (wchłanialny poli-L-laktyd (PLLA) uwalniający lek „-limus”) |
| Dawka leku | 1,4 μg/mm2 |
| Szerokość/grubość przęseł | 150 μm/150 μm |
| Maksymalna średnica rozprężenia |
Średnica nominalna +0,6 mm |
| System dostarczania | |
| Typ cewnika | przeznaczony do szybkiej wymiany |
| Zalecany cewnik prowadzący | 6F (min. śr. wewn. 0,070”) |
| Profil przejścia | 1,5 mm |
| Średnica prowadnika | 0,014” |
| Użytkowa długość cewnika | 140 cm |
| Materiał balonu | Polimer półkrystaliczny |
| Powłoka (trzon dystalny) | Podwójna powłoka |
| Markery | Dwa profilowane markery platynowo-irydowe |
| Średnica trzonu proksymalnego | 2,0 F |
| Średnica trzonu dystalnego | 2,9F |
| Ciśnienie nominalne (NP) | 10 atm |
| Nominalne ciśnienie rozrywające (RBP) | 16 atm |
Tabela kompatybilności
| Balloon diameter (mm) | |||
|---|---|---|---|
| ø 3,00 | ø 3,50 | ||
| Ciśnienie nominalne | atm* | 10 | 10 |
| ø (mm) | 3,00 | 3,54 | |
| Znamionowe ciśnienie rozrywające (RBP) | atm* | 16 | 16 |
| ø (mm) | 3,29 | 3,82 | |
| *1 atm = 1,013 bar |
Informacje dotyczące zamawiania artykułu
| ø rusztowania (mm) |
Długość rusztowania (mm) |
||
|---|---|---|---|
| 15 | 20 | 25 | |
| 3,00 | 412526 | 412527 | 412528 |
| 3,50 | 412529 | 412530 | 412531 |
Pliki do pobrania i dodatkowe linki
Pliki do pobrania
Dodatkowe linki
W czym możemy pomóc?
Literatura
a. Wskazania podano w instrukcji obsługi; b. W oparciu o wyniki badań BIOSOLVE-II, -II/-III i -IV, informacje na temat populacji pacjentów podano w szczegółach dot. badań; c. W porównaniu do wiodącego rusztowania polimerowego – Abbott Absorb; d. Wyniki badań kontrolnych wykonanych po 2 latach w ramach badania BIOSOLVE-IV (n=2066 pacjentów); e. Niepowodzenie w obrębie zmiany docelowej (TLF) obejmuje śmierć sercową i zawał serca z naczynia docelowego (TV-MI); pomostowanie aortalno-wieńcowe wykonane w trybie nagłym (eCABG); rewaskularyzacja zmiany docelowej ze wskazań klinicznych (CD-TLR); f. W 0,4% przypadków po zabiegu nie doszło do wczesnego przerwania leczenia przeciwpłytkowego lub przeciwzakrzepowego; g. Częstotliwość występowania zakrzepicy w obrębie rusztowania z wyłączeniem przypadków, w których doszło do wczesnego przerwania leczenia przeciwpłytkowego lub przeciwzakrzepowego, wyniosła 0,5%; h. Absorb, Abbott; i. BioFreedom, Biosensors.
1. Erbel R. Temporary scaffolding of coronary arteries with bioabsorbable magnesium stents: a prospective, non-randomised multicentre trial. Lancet. 2007 Jun 2;369(9576):1869-1875. doi: 10.1016/S0140-6736(07)60853-8; 2. Haude M et al. Safety and performance of the drug-eluting absorbable metal scaffold (DREAMS) in patients with de-novo coronary lesions: 12 month results of the prospective, multicentre, first in-man BIOSOLVE-I trial. Lancet. 2013 Mar 9;381(9869):836-44; 3. Wang et al. Vascular restoration therapy and bioresorbable vascular scaffold. Regenerative Biomaterials, 2014, 49–55. doi: 10.1093/rb/rbu005; 4. Haude M et al. Safety and performance of the second-generation drug-eluting absorbable metal scaffold in patients with de-novo coronary artery lesions (BIOSOLVE-II): 6 month|results of a prospective, multicentre, non-randomised, first-in-man trial. Lancet. 2 stycznia 2016 r.; 387(10013):31-9. doi: 10.1016/S0140-6736(15)00447-X. Epub 2015 Oct 12; 5. Fajadet J et al. Magmaris preliminary recommendation upon commercial launch: a consensus from the expert panel on 14 April 2016. EuroIntervention. 2016;12:828-833; 6. Torzewski J. Safety and performance of Magmaris at 24 month follow up of BIOSOLVE IV. Referat wygłoszony podczas: eEuroPCR; 2021; wirtualny kongres. ClinicalTrials.gov: NCT02817802; 7. Haude M. Long-term clinical data of the BIOSOLVE-II study with the drug-eluting absorbable metal scaffold in the treatment of subjects with de novo lesions in native coronary arteries - BIOSOLVE-II. Referat wygłoszony podczas: e-Course PCR, 25 czerwca 2020 r., Paryż, Francja; 8. Haude M, et al. Sustained safety and performance of the second-generation sirolimus-eluting absorbable metal scaffold: Pooled outcomes of the BIOSOLVE-II and -III trials at 3 years. Cardiovascular Revascularization Medicine. 2020. doi:10.1016/j.carrev.2020.04.006; 9. Joner M, Ruppelt P, Zumstein P, et al. Preclinical Evaluation of Degradation Kinetics and Elemental Mapping of First and Second Generation Bioresorbable Magnesium Scaffolds. EuroIntervention. 2018 Feb 20. pii: EIJ-D-17-00708. doi: 10.4244/EIJ-D-17-00708. [Epub przed wydaniem papierowym]; 10. Schmidt et al. In vitro performance investigation of bioresorbable scaffolds – standard tests for vascular stents and beyond. Cardiovasc Revasc Med. 2016 Sep;17(6):375-83. doi: 10.1016/j.carrev.2016.05.001. Epub 2016 May 13; 11. Dane w pliku BIOTRONIK; 12. Bennett J. Safety and Efficacy of the Resorbable Magnesium Scaffold, Magmaris in a Real-World Setting – 24-month Follow-up of the Full Cohort (2066 subjects) of the BIOSOLVE-IV Registry. Referat wygłoszony podczas: TCT, wrzesień 2022 r., Boston, USA. ClinicalTrials.gov: NCT02817802; 13. Bennett J. Performance and safety of the resorbable magnesium scaffold, Magmaris in a real-world setting – Primary and secondary endpoint analysis of the full cohort (2,066 subjects) of the BIOSOLVE-IV, Referat wygłoszony podczas: TCT 2021, listopad 2021 r., Orlando, USA. ClinicalTrials.gov: NCT02817802; 14. Torzewski J. Safety and performance of Magmaris at 36-months: BIOSOLVE-IV first cohort. Referat wygłoszony podczas: EuroPCR; 2022; ClinicalTrials.gov: NCT02817802; 15. Haude M, et al. Sustained safety and performance of the second-generation sirolimus-eluting absorbable metal scaffold: Pooled outcomes of the BIOSOLVE-II and -III trials at 3 years. Cardiovascular Revascularization Medicine. 2020. doi: 10.1016/j.carrev.2020.04.006; 16. Haude M, et al. Sustained safety and performance of a second-generation sirolimus-eluting absorbable metal scaffold: Long-term data of the BIOSOLVE-II first-in-man trial at 5 years. Cardiovascular Revascularization Medicine. 2021. doi: 10.1016/j.carrev.2021.07.017; 17. Przypadek z badania BIOSOLVE-II, GER443-012. Źródło: prof. M. Haude, Rheinland Klinikum Neuss GmbH, Neuss, Niemcy 2015; 18. Torzewski J. Safety and performance of Magmaris at 48 months: BIOSOLVE-IV first cohort. Referat wygłoszony podczas: EuroPCR; 2023; ClinicalTrials.gov: NCT02817802.
BIOSOLVE-II i -IV w oparciu o analizę wartości estymatora niepowodzenia Kaplana-Meiera z wykorzystaniem obserwacji uciętych. Zbiorcza analiza wyników BIOSOLVE-II i -III w oparciu o analizę częstotliwości. Analiza danych zebranych w ciągu 36 miesięcy w badaniach BIOSOLVE-II i -III obejmujących okres do 1125 dni po 3 latach.
Magmaris i BIOlute to znaki towarowe lub zastrzeżone znaki towarowe grupy firm BIOTRONIK.
Wszystkie inne znaki towarowe należą do ich właścicieli.