Orsiro®Mission
O Orsiro Mission DES é indicado para melhorar o diâmetro luminal coronário em pacientes com doença cardíaca isquêmica sintomática devido a lesões discretas estenóticas de novo e lesões reestenóticas intrastent (comprimento ≤ 40 mm) nas artérias coronárias nativas com diâmetro do vaso de referência de 2,25 mm a 4,0 mm, incluindo os seguintes subconjuntos de pacientes e lesões:
- Síndrome coronária aguda (ACS)
- Infarto agudo do miocárdio com supradesnivelamento do segmento ST (STEMI)
- Diabetes Mellitus (DM)
- Lesões complexas (B2/C)
- Alto risco de hemorragia (HBR)
- Lesões longas (LL) (por exemplo, ≥ 20 mm)
- Vasos pequenos (SV) (por exemplo, ≤ 2,75 mm)
- Doença multivasos (MVD)
- Masculino/feminino
- Pacientes idosos (por exemplo, > 65 anos)
Principais características do produto
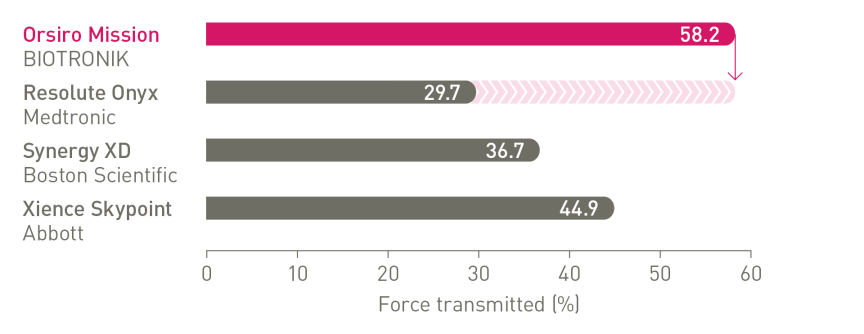
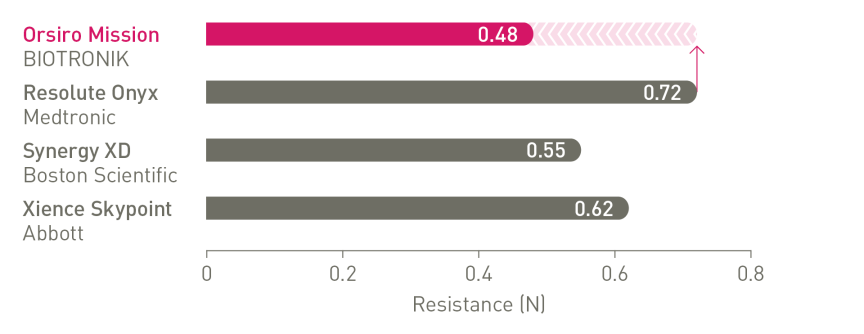
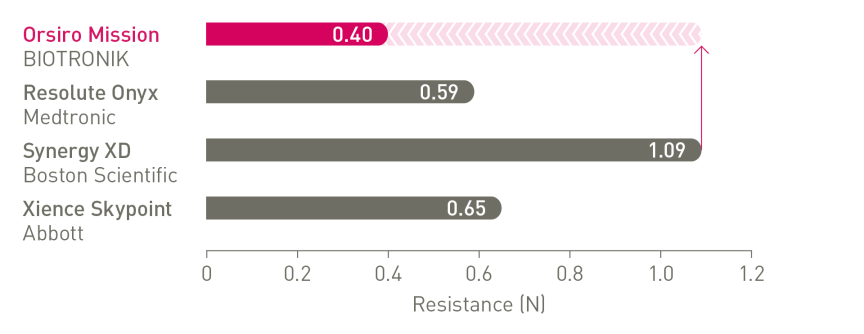
O próximo nível de capacidade de entrega¹
1º em Push, Track e Cross
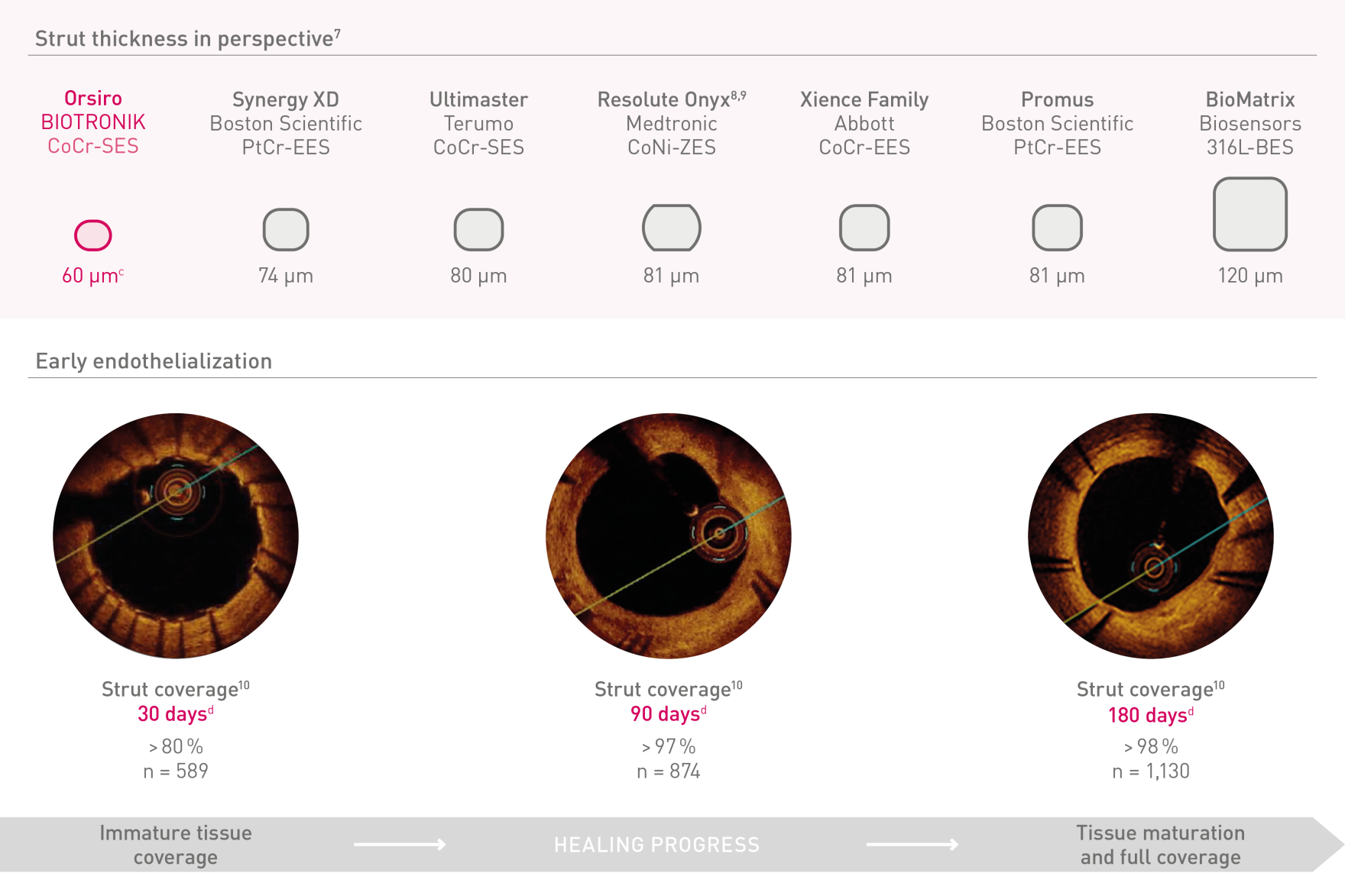
Suportes ultrafinos
Para endotelização precoce
Excelentes resultados para os pacientes
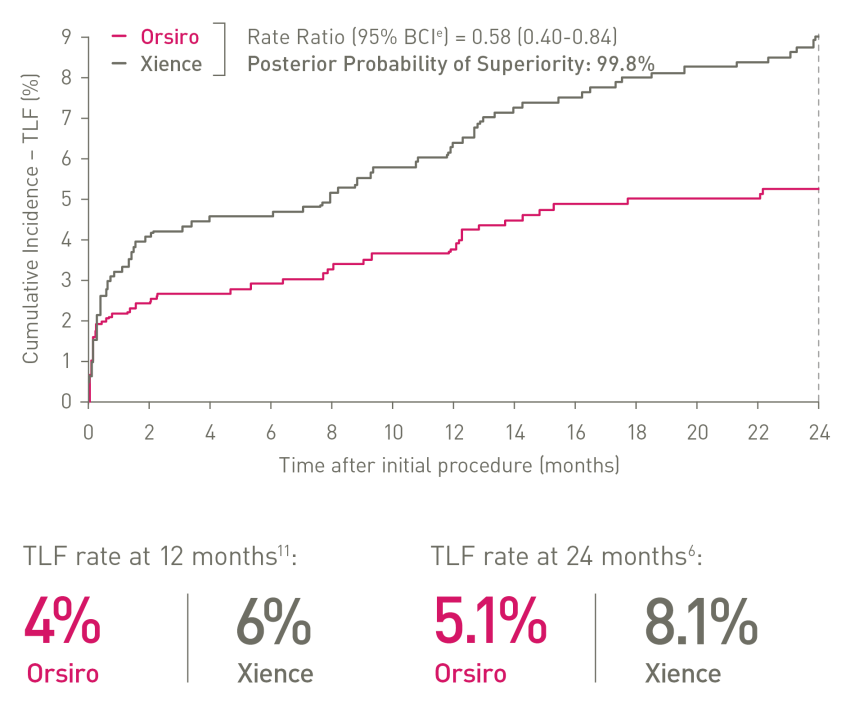
Superioridade comprovada em STEMI
Visão geral do produto
Orsiro Mission
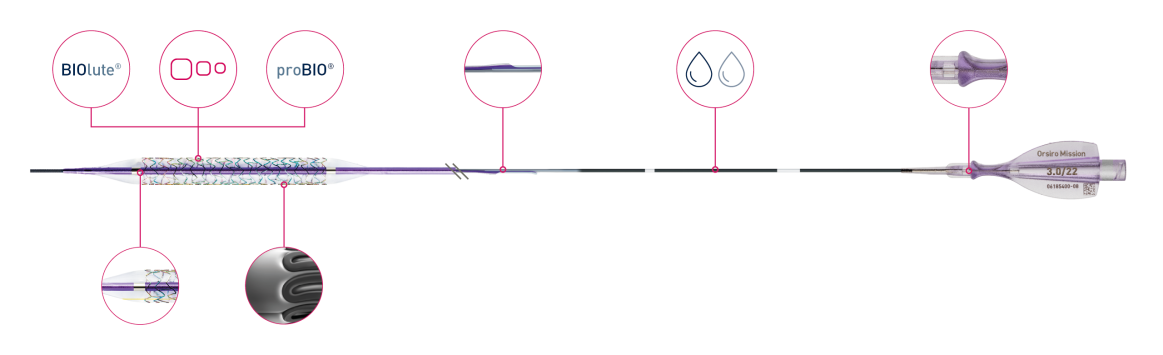
Biologisch absorbeerbare coating
Ultradunne strutten van 60 µmᶜ
Passieve coating
Verbeterde krachtoverbrenging
Dubbele coating
Ergonomische hub
Flexibele schacht
Diepe inbedding
Dados técnicos
| Stent | |
|---|---|
| Material do stent | Liga de cromo-cobalto, L-605 |
| Espessura da haste | ø 2,25 – 3,0 mm: 60 µm (0,0024”); ø 3,50 – 4,0 mm: 80 µm (0,0031") |
| Revestimento passivo | proBIO® (carbeto de silício amorfo) |
| Revestimento ativo | BIOlute® Poli-L-Lactídeo bioabsorvível (PLLA) eluindo um medicamento limus |
| Dose do fármaco | 1,4 µg/mm² |
| Sistema de entrega | |
| Tipo de cateter | Troca rápida |
| Cateter-guia recomendado | 5 F (D.I. mín.0,056") |
| Diâmetro do fio-guia | 0,014" |
| Comprimento útil do cateter | 140 cm |
| Material do balão | Polímero semicristalino |
| Revestimento (shaft distal) | Hidrofílico |
| Revestimento (shaft proximal) | Hidrofóbico |
| Marcas radiopacas | Duas marcas radiopacas de platina-irídio |
| Perfil de entrada na lesão | 0,017" |
| Diâmetro do shaft distal | 2,7 F: ø 2,25 – 3,0 mm; 2,9 F: ø 3,5 – 4,0 mm |
| Diâmetro do shaft proximal | 2,0 F |
| Pressão nominal (NP) | 10 atm |
| Pressão de ruptura nominal (RBP) | 16 atm |
| Armazen ar | |
|---|---|
| Validade (UBD) | 24 meses |
| Temperatura | Entre 15 °C e 25 °C. São permitidas excursões a curto prazo entre 10 °C e 40 °C. |
| Double Helix Stent Design | ||||||
|---|---|---|---|---|---|---|
| Nominal diameter (mm) | 2.25 | 2.5 | 2.75 | 3.0 | 3.5 | 4.0 |
| Strut thickness (μm) | 60 | = | = | = | 80 | = |
| Strut width (μm) | 75 | = | = | = | 85 | = |
| Amount of connectors | 3 | = | = | = | = | = |
| Amount of crowns at end | 8 | = | = | = | = | = |
| Maximal Expansion and Stent Strut Opening | ||||||
|---|---|---|---|---|---|---|
| Nominal diameter (mm) | 2.25 | 2.5 | 2.75 | 3.0 | 3.5 | 4.0 |
| Nominal outer diameter of the stent at NP (mm) | 2.37 | 2.62 | 2.87 | 3.12 | 3.66 | 4.16 |
| Maximal expansion diameter (mm) | 4.0 | = | = | = | 5.0 | = |
| Stent strut opening diameter at NP* (mm) | 0.79 | 0.92 | = | = | 1.06 | 1.25 |
| Maximal diameter of expanded stent cell (mm) | 3.59 | = | = | = | 4.42 | = |
*Mean of the largest possible opening diameter within a stent cell at NP
= symbol used to show repetition
Informações para pedidos
| Ø do stent (mm) |
Comprimento do stent (mm) |
||||||||
|---|---|---|---|---|---|---|---|---|---|
| 9 | 13 | 15 | 18 | 22 | 26 | 30 | 35 | 40 | |
| 2,25 | 419101 | 419107 | 419113 | 419119 | 419125 | 419131 | 419137 | 419143 | 419149 |
| 2,5 | 419102 | 419108 | 419114 | 419120 | 419126 | 419132 | 419138 | 419144 | 419150 |
| 2,75 | 419103 | 419109 | 419115 | 419121 | 419127 | 419133 | 419139 | 419145 | 419151 |
| 3,0 | 419104 | 419110 | 419116 | 419122 | 419128 | 419134 | 419140 | 419146 | 419152 |
| 3,5 | 419105 | 419111 | 419117 | 419123 | 419129 | 419135 | 419141 | 419147 | 419153 |
| 4,0 | 419106 | 419112 | 419118 | 419124 | 419130 | 419136 | 419142 | 419148 | 419154 |
Downloads e links relacionados
Downloads
Gerelateerde links
Mídia
Animações do produto
Como podemos ajudar?
Referências
a. Em comparação com o Resolute Onyx, os dados da BIOTRONIK em arquivo; b. Em comparação com o Synergy XD, os dados da BIOTRONIK em arquivo; c. Ø2,25-3,0 mm; d. Imagens: Secco G et al. Time-related changes in neointimal tissue coverage following a new generation SES implantation: an OCT observational study. Apresentado em: euro PCR, 20 de maio de 2014; Paris, França; e. Intervalo de Credibilidade Bayesiano; f. Em comparação com o Xience, baseado em TLF, no ensaio BIOSTEMI aos 2 anos; g. Em comparação com o Xience, com base em taxas mais baixas estatisticamente significativas de TV-MI e taxas de ST definitivas/prováveis tardias/muito tardias do ensaio BIOFLOW-V ao longo de 5 anos; h. valores de p para análise frequentista de 60 meses; i Em comparação com o Xience, com base nos resultados de 5 anos do BIOFLOW-V; j. Orsiro e Missão Orsiro DES; k. Pacientes globais, resultados de 5 anos do BIO-RESORT; eu. Com base em TLF SUCRA (superfície sob a curva de classificação cumulativa) de 1 ano, meta-análise da rede Taglieri; m. Em comparação com o Xience, com base em uma Taxa de Taxa de 0,58, no teste BIOSTEMI em 2 anos.
1. Em comparação com Xience Sierra, Resolute Onyx e Synergy para testes laboratoriais sobre empurre, navegabilidade e cruzamento, dados em arquivo da BIOTRONIK; 2. Tal como caracterizado com relação à espessura da haste na metanálise de Bangalore et al.; 3. Com base na interpretação do investigador dos resultados do endpoint primário do estudo BIOFLOW-V; 4. Dados em arquivo da BIOTRONIK; 5. De acordo com a interpretação dos investigadores em Secco et al. Observações seriais de dados de imagem.Secco GG et al.Time-related changes in neointimal tissue coverage of a novel Sirolimus eluting stent: Serial observations with optical coherence tomography. Cardiovascular Revascularization Medicine. 2016; 17(1): 38-43; 6. Pilgrim et al. Biodegradable – versus durable-polymer drug-eluting stents for STEMI. Final 2-year outcomes of the BIOSTEMI trial. J Am Coll Cardiol. Cardiovasc Interven. 2021, doi: 10.1016/j.jcin.2020.12.011; 7. Stefanini GG et al. Coronary stents: novel developments. Heart. 1 de julho de 2014; 100(13):1051-61; 8. Low AF. Stent platform for procedural success: Apresentando o Senoidal Contínuo & Tecnologias de fio central.Apresentado em: AsiaPCR; 22 a 24 de janeiro de 2015; Singapura, Singapura; 9. Tolentino A. Evolving DES Strategy: Biodegradable Polymer vs. Bioabsorbable Scaffold. Apresentado em: Cardiovascular Nurse/Technologist Symposium; 17 de junho de 2016; Nova York, EUA; 10. Secco G et al. Time-related changes in neointimal tissue coverage of a novel Sirolimus eluting stent: Serial observations with optical coherence tomography. Cardiovascular Revascularization Medicine 17.1 (2016): 38-43; 11. Iglesias JF, et al. Stents de polímero biodegradável eluidores de sirolimus versus stents eluidores de polímero durável de everolimus em pacientes com infarto do miocárdio com elevação do segmento ST (BIOSTEMI) The Lancet.5 de outubro de 2019;394(10205):1243-53; 12.Kandzari D et al. Ultrathin Bioresorbable Polymer Sirolimus-Eluting Stents versus Thin Durable Polymer Everolimus-Eluting Stents for Coronary Revascularization: Final 5-year Outcomes from the Randomized BIOFLOW V Trial, manuscrito submetido à JACC, 2022: NCT02389946; 13. Dados da BIOTRONIK em arquivo, status de fevereiro de 2023; 14. De acordo com a interpretação dos investigadores dos estudos pré-clínicos com o Orsiro, conforme mencionado em Cassese et al. J Thorac Dis 2018;10(2):688-692; 15. E.Ploumen, Resultados de 5 anos do BIO-RESORT e subgrupo diabético, TCT 2021; 16.Taglieri N et al. Target lesion failure with current drug-eluting stents: Evidence from a comprehensive network meta-analysis. JACC 2020 13(24):2868-78.
Dados clínicos coletados com o dispositivo Orsiro DES dentro do programa clínico da família Orsiro
Orsiro, Orsiro Mission, proBIO e BIOlute são marcas comerciais ou marcas registradas do grupo de empresas BIOTRONIK. Todas as outras marcas são propriedade dos seus respectivos proprietários.